Você sabia que 90% de toda a serotonina do seu corpo é produzida no intestino, não no cérebro? Esta descoberta revolucionária está transformando nossa compreensão sobre saúde mental e abrindo novos caminhos para o tratamento de depressão, ansiedade e outros transtornos psiquiátricos [1].
Segundo a Organização Mundial da Saúde, mais de 320 milhões de pessoas sofrem de depressão globalmente, enquanto 260 milhões vivem com transtornos de ansiedade [2]. No Brasil, somos líderes mundiais em prevalência de ansiedade, afetando 9,3% da população, e ocupamos o quinto lugar em taxas de depressão [3]. Diante desses números alarmantes e das limitações dos tratamentos convencionais, a ciência voltou seus olhos para uma conexão surpreendente: o eixo intestino-cérebro.
Esta comunicação bidirecional entre nosso sistema digestivo e sistema nervoso central está revelando que a saúde mental pode estar literalmente “nas nossas entranhas”. O microbioma intestinal, composto por trilhões de microrganismos que habitam nosso trato digestivo, emerge como um player fundamental na regulação do humor, cognição e bem-estar emocional.
Neste artigo, exploraremos as evidências científicas mais recentes sobre como nossos “inquilinos microscópicos” influenciam nossos pensamentos, emoções e comportamentos. Descobriremos como a disbiose intestinal pode contribuir para transtornos mentais e, mais importante, como podemos usar esse conhecimento para promover saúde mental através de estratégias baseadas no microbioma.
O Segundo Cérebro: Entendendo o Sistema Nervoso Entérico
O intestino humano abriga aproximadamente 500 milhões de neurônios, uma quantidade comparável à encontrada na medula espinhal [4]. Esta impressionante rede neural, conhecida como sistema nervoso entérico (SNE), é tão complexa e autônoma que os cientistas a apelidaram de “segundo cérebro”.
Diferentemente do que muitos imaginam, o SNE não é apenas um conjunto de nervos que controla a digestão. Ele é um sistema sofisticado capaz de operar independentemente do cérebro principal, processando informações, tomando decisões e até mesmo “aprendendo” com experiências passadas. Esta autonomia explica por que podemos digerir alimentos mesmo durante o sono ou quando estamos inconscientes.
O sistema nervoso entérico produz mais de 30 neurotransmissores diferentes, muitos dos quais são idênticos aos encontrados no cérebro [5]. Entre eles estão a serotonina, dopamina, GABA, acetilcolina e noradrenalina – todos cruciais para a regulação do humor, ansiedade, motivação e cognição. Esta sobreposição bioquímica não é coincidência; ela reflete a íntima conexão evolutiva entre intestino e cérebro.
A arquitetura neural do intestino é organizada em duas camadas principais: o plexo mioentérico (plexo de Auerbach) e o plexo submucoso (plexo de Meissner). O plexo mioentérico controla principalmente a motilidade intestinal, enquanto o plexo submucoso regula a secreção e absorção. Ambos trabalham em coordenação para manter a homeostase intestinal e comunicar-se constantemente com o cérebro através do nervo vago.
Pesquisas recentes revelam que o SNE possui características surpreendentemente similares ao sistema nervoso central. Ele contém células gliais que suportam e protegem os neurônios, possui barreiras seletivas similares à barreira hematoencefálica e até mesmo exibe plasticidade neural – a capacidade de formar novas conexões em resposta a experiências [6].
Esta complexidade neural explica por que distúrbios intestinais frequentemente vêm acompanhados de sintomas neuropsiquiátricos. Pacientes com síndrome do intestino irritável, por exemplo, apresentam taxas significativamente maiores de depressão e ansiedade comparados à população geral. A conexão não é apenas psicossomática; ela é fundamentalmente neurobiológica.
O Eixo Intestino-Cérebro: Uma Via de Mão Dupla
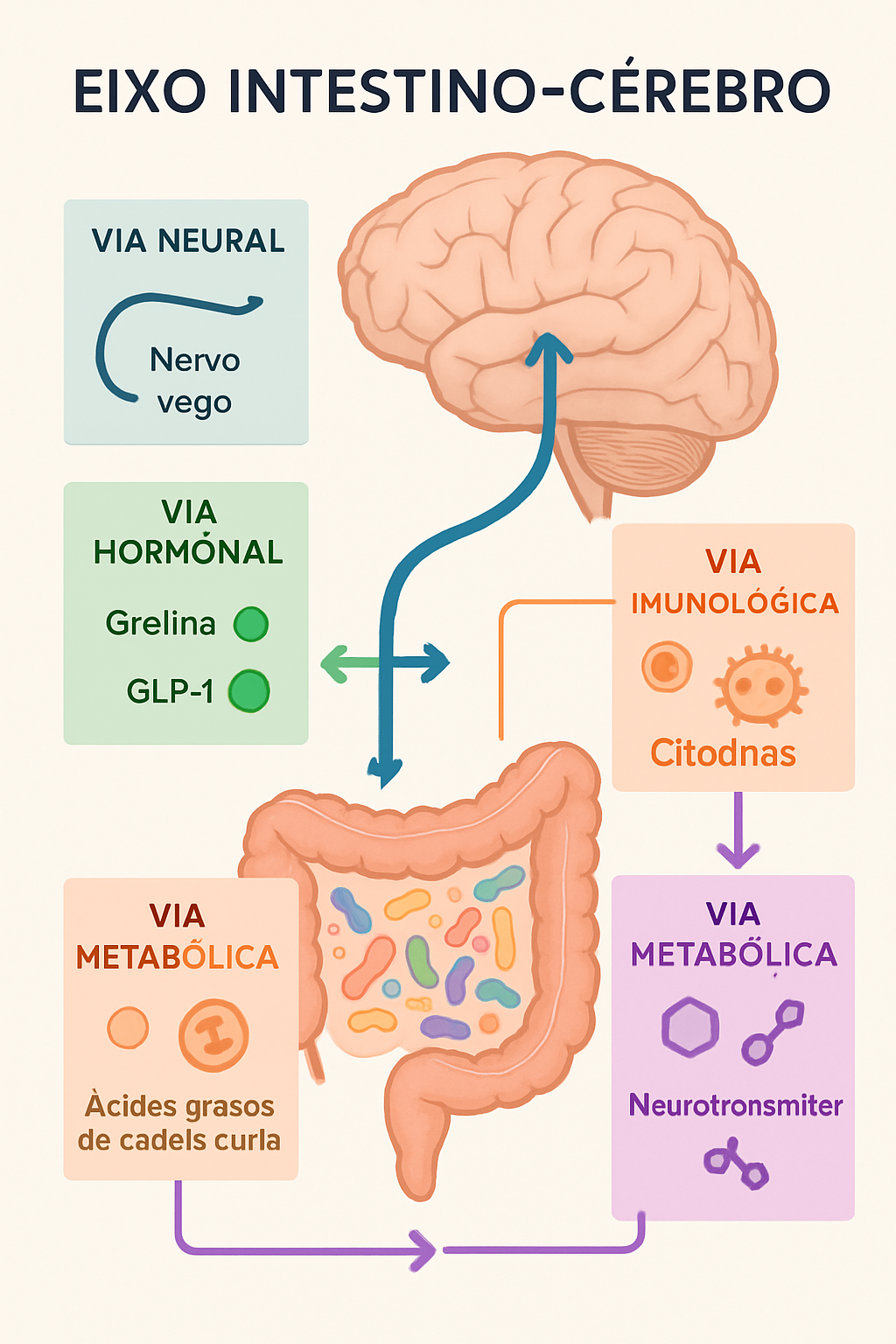
A comunicação entre intestino e cérebro ocorre através de múltiplas vias que funcionam como uma sofisticada rede de informações bidirecionais. Esta comunicação não é apenas ocasional; ela é constante, dinâmica e fundamental para nossa saúde física e mental [7].
A via neural representa o canal de comunicação mais direto entre intestino e cérebro. O nervo vago, o décimo par craniano, serve como a principal “autoestrada” de informações entre esses dois sistemas. Este nervo transmite sinais em ambas as direções: do cérebro para o intestino (via eferente) e do intestino para o cérebro (via aferente). Estudos mostram que aproximadamente 80% das fibras do nervo vago são aferentes, ou seja, carregam informações do intestino para o cérebro, sugerindo que o intestino tem muito a “dizer” ao cérebro [8].
A estimulação do nervo vago tem demonstrado efeitos antidepressivos em estudos clínicos, tanto que a estimulação vagal é aprovada pela FDA como tratamento para depressão resistente a medicamentos. Esta eficácia terapêutica reforça a importância da comunicação intestino-cérebro na regulação do humor.
A via hormonal constitui outro canal crucial de comunicação. O intestino produz mais de 20 hormônios diferentes que podem influenciar o cérebro, incluindo a grelina (hormônio da fome), GLP-1 (peptídeo similar ao glucagon), CCK (colecistocinina) e PYY (peptídeo YY) [9]. Estes hormônios não apenas regulam o apetite e metabolismo, mas também afetam diretamente centros cerebrais relacionados ao humor e cognição.
O eixo hipotálamo-hipófise-adrenal (HPA) representa uma via endócrina particularmente importante na conexão intestino-cérebro. O estresse ativa este eixo, levando à liberação de cortisol, que por sua vez afeta a permeabilidade intestinal e a composição do microbioma. Esta alteração no microbioma pode então influenciar a produção de neurotransmissores intestinais, criando um ciclo de feedback que pode perpetuar estados de ansiedade e depressão [10].
A via imunológica adiciona outra camada de complexidade à comunicação intestino-cérebro. O intestino abriga aproximadamente 70% de todo o sistema imunológico do corpo, e a microbiota intestinal desempenha um papel crucial na modulação da resposta imune [11]. Quando há disbiose (desequilíbrio microbiano), pode ocorrer inflamação intestinal que se propaga sistemicamente, afetando o cérebro através de citocinas pró-inflamatórias como IL-1β, IL-6 e TNF-α.
Estas citocinas podem atravessar a barreira hematoencefálica e ativar a microglia cerebral, levando à neuroinflamação. A neuroinflamação está implicada na patogênese de diversos transtornos psiquiátricos, incluindo depressão maior, transtorno bipolar e esquizofrenia. Este mecanismo explica por que condições inflamatórias intestinais frequentemente coexistem com transtornos mentais.
A via metabólica representa um canal adicional de comunicação através dos metabólitos produzidos pela microbiota intestinal. Ácidos graxos de cadeia curta (AGCC) como butirato, propionato e acetato são produzidos pela fermentação bacteriana de fibras dietéticas. Estes metabólitos podem atravessar a barreira hematoencefálica e exercer efeitos neuroprotetores, anti-inflamatórios e neuromoduladores [12].
Microbioma Intestinal: O Ecossistema Interno
O microbioma intestinal humano é um ecossistema complexo composto por trilhões de microrganismos, incluindo bactérias, vírus, fungos, arqueas e protozoários [13]. Este “órgão esquecido” pesa aproximadamente 1,5 kg em um adulto médio e contém mais células microbianas do que células humanas em nosso corpo.
A diversidade microbiana é impressionante: mais de 1000 espécies bacterianas diferentes podem habitar um único intestino humano. Os filos bacterianos dominantes são Firmicutes e Bacteroidetes, que juntos representam cerca de 90% da microbiota intestinal. Outros filos importantes incluem Actinobacteria, Proteobacteria e Verrucomicrobia [14].
Esta diversidade não é aleatória; ela reflete um processo evolutivo de milhões de anos de coevolução entre humanos e microrganismos. Nossos ancestores desenvolveram uma relação simbiótica com estes microrganismos, onde ambos os lados se beneficiam: nós fornecemos habitat e nutrientes, enquanto eles nos ajudam na digestão, síntese de vitaminas, proteção contra patógenos e modulação do sistema imunológico.
O microbioma intestinal desempenha funções essenciais que vão muito além da digestão. Ele sintetiza vitaminas do complexo B, incluindo B12, folato, biotina e riboflavina, além da vitamina K [15]. Estas vitaminas são cruciais para o funcionamento neurológico adequado, e deficiências podem contribuir para sintomas neuropsiquiátricos.
A função de barreira é outra contribuição vital do microbioma. Bactérias benéficas competem com patógenos por nutrientes e sítios de adesão, produzem substâncias antimicrobianas e fortalecem a integridade da barreira intestinal. Quando esta função está comprometida, pode ocorrer “intestino permeável”, permitindo que toxinas e antígenos atravessem a parede intestinal e desencadeiem respostas inflamatórias sistêmicas.
O conceito de eubiose versus disbiose é fundamental para compreender a saúde do microbioma. Eubiose refere-se a um estado de equilíbrio microbiano, caracterizado por alta diversidade, predominância de espécies benéficas e estabilidade ao longo do tempo. Disbiose, por outro lado, representa um desequilíbrio caracterizado por redução da diversidade, proliferação de espécies potencialmente patogênicas e instabilidade [16].
Múltiplos fatores podem influenciar a composição do microbioma intestinal. A dieta é provavelmente o fator mais importante: dietas ricas em fibras promovem diversidade microbiana, enquanto dietas processadas e pobres em fibras reduzem a diversidade. Antibióticos podem causar perturbações dramáticas no microbioma, com efeitos que podem persistir por meses ou anos após o tratamento.
O estresse psicológico também afeta profundamente o microbioma através do eixo HPA. Estudos mostram que o estresse crônico pode reduzir a diversidade microbiana e alterar a proporção de diferentes espécies bacterianas. Esta alteração pode então contribuir para sintomas de ansiedade e depressão, criando um ciclo vicioso.
Outros fatores que influenciam o microbioma incluem idade, genética, modo de nascimento (parto vaginal versus cesariana), amamentação, uso de medicamentos (especialmente inibidores da bomba de prótons), exercício físico, sono e exposição a toxinas ambientais [17].
A Produção de Neurotransmissores no Intestino
Uma das descobertas mais fascinantes da neurociência moderna é que o intestino produz a maioria dos neurotransmissores que associamos ao cérebro. Esta produção não é incidental; ela é fundamental para a comunicação intestino-cérebro e para a regulação do humor e comportamento [18].
A serotonina representa o exemplo mais impressionante desta produção intestinal de neurotransmissores. Aproximadamente 90% de toda a serotonina corporal é sintetizada no intestino pelas células enterocromafins, um tipo especializado de célula neuroendócrina [19]. Esta serotonina intestinal não apenas regula a motilidade e secreção intestinal, mas também comunica com o cérebro através do nervo vago.
A síntese de serotonina no intestino depende da disponibilidade de triptofano, um aminoácido essencial obtido através da dieta. Interessantemente, a microbiota intestinal pode influenciar tanto a disponibilidade quanto o metabolismo do triptofano. Algumas bactérias podem produzir triptofano, enquanto outras podem degradá-lo ou competir por ele. Esta competição microbiana pelo triptofano pode afetar diretamente os níveis de serotonina e, consequentemente, o humor [20].
Estudos mostram que pessoas com depressão frequentemente apresentam níveis reduzidos de triptofano e alterações na microbiota intestinal que afetam o metabolismo deste aminoácido. Suplementação com triptofano ou seu precursor 5-HTP tem demonstrado efeitos antidepressivos em alguns estudos, embora os resultados sejam variáveis.
O GABA (ácido gama-aminobutírico) é outro neurotransmissor importante produzido no intestino. Várias espécies de Lactobacillus são capazes de produzir GABA através da descarboxilação do glutamato [21]. O GABA é o principal neurotransmissor inibitório do sistema nervoso central, responsável por promover calma e reduzir ansiedade.
Estudos pré-clínicos mostram que camundongos tratados com Lactobacillus rhamnosus produtores de GABA apresentam redução nos comportamentos relacionados à ansiedade e depressão. Embora o GABA produzido no intestino não atravesse facilmente a barreira hematoencefálica, ele pode influenciar o cérebro através da estimulação do nervo vago.
A dopamina, neurotransmissor associado à motivação, prazer e recompensa, também é produzida no intestino. Enterococcus e Bacillus são exemplos de bactérias capazes de sintetizar dopamina [22]. Níveis adequados de dopamina são essenciais para manter motivação, foco e sensação de bem-estar.
Deficiências de dopamina estão associadas a sintomas depressivos, particularmente anedonia (incapacidade de sentir prazer) e falta de motivação. A produção intestinal de dopamina pode contribuir para os níveis sistêmicos deste neurotransmissor, embora a maior parte da dopamina cerebral seja produzida localmente no cérebro.
A acetilcolina, importante para memória e cognição, também é sintetizada no intestino. Lactobacillus plantarum é uma das espécies capazes de produzir acetilcolina [23]. Este neurotransmissor é crucial para a função colinérgica, que está envolvida na regulação do humor, atenção e processos cognitivos.
Outros neurotransmissores produzidos no intestino incluem noradrenalina (por Escherichia, Bacillus e Saccharomyces), histamina (por Lactobacillus e Streptococcus) e até mesmo precursores de endorfinas [24]. Esta produção diversificada de neurotransmissores pelo microbioma intestinal sugere que nossa saúde mental está intimamente ligada à saúde de nossos microrganismos intestinais.
Disbiose e Transtornos Mentais
A disbiose intestinal, caracterizada pelo desequilíbrio na composição e função da microbiota intestinal, está emergindo como um fator significativo no desenvolvimento e manutenção de transtornos mentais [25]. Esta conexão não é meramente correlacional; evidências crescentes sugerem relações causais diretas entre alterações microbianas e sintomas neuropsiquiátricos.
A disbiose pode manifestar-se de várias formas: redução da diversidade microbiana (perda de espécies), alteração na proporção de diferentes filos bacterianos, proliferação de espécies potencialmente patogênicas, ou perda de espécies benéficas específicas. Cada uma dessas alterações pode contribuir para disfunções no eixo intestino-cérebro [26].
Estudos em pacientes com depressão maior revelam padrões consistentes de disbiose. Uma meta-análise de 2019 que analisou 26 estudos encontrou redução significativa na diversidade microbiana em pacientes deprimidos comparados a controles saudáveis [27]. Especificamente, observou-se redução nas populações de Bifidobacterium, Lactobacillus e Faecalibacterium prausnitzii, bactérias conhecidas por seus efeitos benéficos na saúde mental.
A redução de Faecalibacterium prausnitzii é particularmente significativa, pois esta bactéria é um dos principais produtores de butirato, um ácido graxo de cadeia curta com propriedades anti-inflamatórias e neuroprotetoras. Níveis reduzidos de butirato estão associados a aumento da permeabilidade intestinal e inflamação sistêmica, ambos implicados na patogênese da depressão [28].
Pacientes com transtornos de ansiedade também apresentam alterações microbianas características. Estudos mostram redução nas populações de Lactobacillus helveticus e Bifidobacterium longum, espécies que demonstraram efeitos ansiolíticos em estudos pré-clínicos e clínicos [29]. Simultaneamente, observa-se aumento em espécies potencialmente patogênicas como certas cepas de Escherichia coli e Enterococcus.
O mecanismo pelo qual a disbiose contribui para transtornos mentais é multifatorial. Primeiro, a alteração na produção de neurotransmissores intestinais pode afetar diretamente o humor e comportamento. Redução nas populações de bactérias produtoras de GABA e serotonina pode contribuir para sintomas de ansiedade e depressão.
Segundo, a disbiose frequentemente resulta em aumento da permeabilidade intestinal, condição conhecida como “intestino permeável” ou “leaky gut”. Quando a barreira intestinal está comprometida, lipopolissacarídeos (LPS) bacterianos e outras toxinas podem entrar na circulação sistêmica, desencadeando respostas inflamatórias [30].
Estes LPS são reconhecidos pelo sistema imunológico como sinais de perigo, levando à produção de citocinas pró-inflamatórias como IL-1β, IL-6 e TNF-α. Estas citocinas podem atravessar a barreira hematoencefálica e ativar a microglia cerebral, resultando em neuroinflamação. A neuroinflamação crônica está fortemente associada a sintomas depressivos e cognitivos [31].
Terceiro, a disbiose pode afetar o metabolismo do triptofano através da via da quinurenina. Em estados inflamatórios, a enzima indoleamina 2,3-dioxigenase (IDO) é ativada, desviando o triptofano da síntese de serotonina para a produção de metabólitos da quinurenina. Alguns destes metabólitos, como o ácido quinolínico, são neurotóxicos e podem contribuir para sintomas depressivos [32].
Quarto, a disbiose pode afetar a produção de ácidos graxos de cadeia curta (AGCC), particularmente butirato, propionato e acetato. Estes metabólitos têm efeitos anti-inflamatórios, fortalecem a barreira intestinal e podem influenciar a função cerebral. Redução na produção de AGCC está associada a aumento da inflamação e maior risco de transtornos mentais [33].
Evidências Científicas: Estudos e Pesquisas
A evidência científica para a conexão microbioma-saúde mental vem de múltiplas linhas de pesquisa, desde estudos em animais germ-free até ensaios clínicos randomizados em humanos. Esta convergência de evidências fortalece significativamente nossa compreensão sobre o papel do microbioma na saúde mental [34].
Os estudos em animais germ-free (livres de germes) forneceram algumas das evidências mais convincentes para a importância do microbioma na função cerebral. Estes animais, criados em ambiente estéril desde o nascimento, apresentam alterações dramáticas no desenvolvimento e função do sistema nervoso [35].
Camundongos germ-free exibem comportamentos anômalos relacionados à ansiedade e cognição. Eles mostram redução no comportamento exploratório, alterações na resposta ao estresse e déficits de memória. Mais impressionante ainda, muitas dessas alterações podem ser revertidas através da colonização com microbiota normal, mas apenas se realizada durante uma “janela crítica” de desenvolvimento [36].
Estudos de colonização seletiva revelaram que diferentes espécies bacterianas podem ter efeitos específicos no comportamento. Por exemplo, a colonização de camundongos germ-free com Bifidobacterium infantis reduziu comportamentos depressivos, enquanto Lactobacillus helveticus diminuiu comportamentos relacionados à ansiedade [37].
Experimentos de transplante de microbiota fecal (TMF) forneceram evidências ainda mais diretas para a causalidade. Quando microbiota de pacientes deprimidos é transplantada para camundongos germ-free, os animais desenvolvem comportamentos semelhantes à depressão. Conversamente, transplante de microbiota de indivíduos saudáveis pode reverter comportamentos depressivos em modelos animais [38].
Um estudo particularmente elegante transplantou microbiota de pacientes com transtorno depressivo maior para ratos germ-free. Os animais receptores desenvolveram comportamentos anedônicos (perda de prazer), alterações na neuroquímica cerebral e respostas inflamatórias similares às observadas em humanos deprimidos [39].
Estudos observacionais em humanos têm consistentemente demonstrado associações entre composição do microbioma e saúde mental. Uma análise de 2019 que incluiu mais de 1000 participantes encontrou correlações significativas entre diversidade microbiana e qualidade de vida relacionada à saúde mental [40].
Ensaios clínicos randomizados controlados por placebo representam o padrão-ouro para evidência científica. Uma meta-análise de 2020 que incluiu 34 estudos com mais de 2000 participantes encontrou que suplementação probiótica resultou em melhorias significativas em sintomas de depressão e ansiedade [41].
Os efeitos foram mais pronunciados em estudos que utilizaram múltiplas cepas probióticas, durações de tratamento mais longas (8-12 semanas) e em participantes com sintomas basais mais severos. Cepas específicas como Lactobacillus helveticus R0052 e Bifidobacterium longum R0175 mostraram efeitos particularmente consistentes.
Um estudo duplo-cego controlado por placebo com 40 pacientes com depressão maior encontrou que suplementação com Lactobacillus helveticus e Bifidobacterium longum por 8 semanas resultou em melhorias significativas nos escores de depressão comparado ao placebo [42]. Importante, os benefícios persistiram por 4 semanas após a descontinuação do tratamento.
Estudos de neuroimagem estão começando a revelar os mecanismos cerebrais pelos quais o microbioma influencia a saúde mental. Ressonância magnética funcional em participantes que receberam probióticos mostra alterações na atividade de regiões cerebrais envolvidas no processamento emocional, incluindo amígdala, córtex pré-frontal e córtex cingulado anterior [43].
Probióticos: Os “Psicobióticos” da Nova Era
O termo “psicobióticos” foi cunhado em 2013 para descrever microrganismos vivos que, quando administrados em quantidades adequadas, conferem benefícios à saúde mental do hospedeiro [44]. Esta nova categoria de probióticos representa uma fronteira promissora no tratamento de transtornos mentais.
Nem todos os probióticos são psicobióticos. Para ser classificado como tal, um microrganismo deve demonstrar efeitos específicos na função cerebral e comportamento através de mecanismos que envolvem o eixo intestino-cérebro. Estes efeitos devem ser demonstrados em estudos controlados e os mecanismos de ação devem ser pelo menos parcialmente compreendidos [45].
Várias cepas específicas emergiram como psicobióticos promissores baseados em evidências científicas robustas. Lactobacillus helveticus R0052 é uma das cepas mais estudadas, demonstrando efeitos ansiolíticos e antidepressivos em múltiplos estudos clínicos. Esta cepa produz GABA e tem a capacidade de modular a resposta ao estresse através do eixo HPA [46].
Bifidobacterium longum R0175, frequentemente estudado em combinação com L. helveticus, também demonstrou efeitos consistentes na redução de ansiedade e depressão. Esta cepa parece exercer seus efeitos através da modulação da inflamação e da produção de metabólitos neuroativos [47].
Lactobacillus rhamnosus JB-1 ganhou atenção após estudos mostrarem que pode modular receptores GABA no cérebro através da estimulação do nervo vago. Camundongos tratados com esta cepa apresentaram redução significativa em comportamentos relacionados à ansiedade e depressão [48].
Bifidobacterium infantis 35624 demonstrou efeitos antidepressivos em modelos animais e capacidade de normalizar a resposta imune em pacientes com síndrome do intestino irritável, uma condição frequentemente comórbida com transtornos de ansiedade [49].
Os mecanismos pelos quais os psicobióticos exercem seus efeitos são diversos e complexos. A produção de neurotransmissores representa um mecanismo direto: diferentes cepas podem produzir GABA, serotonina, dopamina, acetilcolina e outros neurotransmissores que influenciam o humor e comportamento [50].
A modulação da inflamação é outro mecanismo importante. Psicobióticos podem reduzir a produção de citocinas pró-inflamatórias e aumentar citocinas anti-inflamatórias, resultando em redução da neuroinflamação. Eles também podem fortalecer a barreira intestinal, reduzindo a translocação de LPS e outras toxinas [51].
A produção de ácidos graxos de cadeia curta representa um terceiro mecanismo. Embora nem todos os psicobióticos produzam AGCC diretamente, eles podem modular o microbioma de forma a aumentar a produção destes metabólitos benéficos por outras bactérias [52].
A modulação do eixo HPA é outro mecanismo crucial. Alguns psicobióticos podem reduzir os níveis de cortisol e normalizar a resposta ao estresse, efeitos que podem contribuir para melhorias no humor e ansiedade [53].
A seleção de psicobióticos apropriados deve considerar vários fatores. A especificidade da cepa é crucial – efeitos observados com uma cepa específica não podem ser extrapolados para outras cepas da mesma espécie. A dosagem também é importante, com a maioria dos estudos utilizando doses entre 1-10 bilhões de unidades formadoras de colônias (UFC) por dia [54].
A duração do tratamento é outro fator crítico. A maioria dos estudos mostra que benefícios significativos requerem pelo menos 4-8 semanas de suplementação, com alguns estudos sugerindo que 12 semanas podem ser necessárias para efeitos máximos [55].
A qualidade do produto é fundamental. Probióticos são produtos vivos que podem perder viabilidade durante armazenamento e transporte. Produtos de qualidade devem garantir a viabilidade das cepas até a data de expiração e utilizar cepas com evidência científica específica [56].
Alimentação e Saúde Mental
A relação entre alimentação e saúde mental através do microbioma intestinal representa uma das áreas mais promissoras da psiquiatria nutricional. O que comemos não apenas nutre nosso corpo, mas também alimenta trilhões de microrganismos que, por sua vez, influenciam nosso humor, cognição e bem-estar emocional [57].
A dieta mediterrânea emergiu como o padrão alimentar mais consistentemente associado à melhor saúde mental e maior diversidade microbiana. Caracterizada por alto consumo de frutas, vegetais, grãos integrais, legumes, nozes, azeite de oliva e peixes, esta dieta fornece abundantes fibras prebióticas e compostos anti-inflamatórios [58].
Estudos observacionais mostram que aderência à dieta mediterrânea está associada a redução de 25-35% no risco de depressão. O estudo PREDIMED, um ensaio clínico randomizado com mais de 7000 participantes, encontrou que intervenção com dieta mediterrânea resultou em redução significativa na incidência de depressão comparado a uma dieta controle [59].
Os mecanismos pelos quais a dieta mediterrânea beneficia a saúde mental são múltiplos. Primeiro, ela promove diversidade microbiana através do fornecimento de fibras prebióticas variadas. Diferentes tipos de fibras alimentam diferentes espécies bacterianas, promovendo um ecossistema microbiano diverso e resiliente [60].
Segundo, a dieta mediterrânea é rica em compostos polifenólicos encontrados em frutas, vegetais, azeite de oliva e vinho tinto. Estes compostos têm efeitos anti-inflamatórios diretos e também servem como prebióticos, promovendo o crescimento de bactérias benéficas como Bifidobacterium e Lactobacillus [61].
Terceiro, o alto consumo de peixes ricos em ômega-3 fornece ácidos graxos essenciais que têm efeitos anti-inflamatórios e neuroprotetores. Ômega-3 também pode modular a composição do microbioma, promovendo espécies produtoras de AGCC [62].
Os alimentos prebióticos merecem atenção especial na promoção da saúde mental através do microbioma. Prebióticos são fibras não digeríveis que servem como alimento para bactérias benéficas. Exemplos incluem inulina (encontrada em alcachofra, alho, cebola), fruto-oligossacarídeos (banana, aspargo), e beta-glucanos (aveia, cevada) [63].
Estudos mostram que suplementação com prebióticos pode melhorar sintomas de ansiedade e depressão. Um estudo duplo-cego controlado por placebo encontrou que suplementação com galacto-oligossacarídeos por 3 semanas resultou em redução significativa na atenção a estímulos negativos, um marcador de viés cognitivo associado à ansiedade e depressão [64].
Alimentos fermentados representam outra categoria importante para a saúde mental. Kefir, iogurte, kimchi, chucrute, kombucha e miso contêm microrganismos vivos que podem contribuir para a diversidade microbiana intestinal. Estudos observacionais mostram associações entre consumo de alimentos fermentados e menor risco de depressão e ansiedade [65].
Por outro lado, certos padrões alimentares podem prejudicar o microbioma e a saúde mental. A dieta ocidental típica, caracterizada por alto consumo de alimentos processados, açúcares refinados, gorduras saturadas e baixo consumo de fibras, está associada a redução da diversidade microbiana e aumento do risco de depressão [66].
Alimentos ultraprocessados são particularmente problemáticos. Eles frequentemente contêm aditivos como emulsificantes, conservantes e adoçantes artificiais que podem alterar negativamente o microbioma. Estudos mostram que consumo de alimentos ultraprocessados está associado a aumento do risco de depressão de forma dose-dependente [67].
O açúcar refinado merece atenção especial. Consumo excessivo de açúcar pode promover o crescimento de espécies bacterianas potencialmente patogênicas e reduzir a diversidade microbiana. Estudos mostram que dietas ricas em açúcar estão associadas a aumento da inflamação e maior risco de depressão [68].
Estratégias nutricionais específicas podem ser implementadas para otimizar o microbioma para saúde mental. Aumentar gradualmente o consumo de fibras é fundamental, visando pelo menos 25-35 gramas por dia de fontes variadas. Incluir alimentos fermentados regularmente pode contribuir para a diversidade microbiana [69].
Reduzir alimentos processados e açúcares refinados é igualmente importante. Focar em alimentos integrais, minimamente processados fornece não apenas prebióticos, mas também vitaminas, minerais e compostos bioativos que suportam a saúde mental [70].
O timing das refeições também pode ser relevante. Estudos emergentes sugerem que jejum intermitente pode beneficiar o microbioma e a saúde mental, embora mais pesquisas sejam necessárias para estabelecer protocolos ótimos [71].
Fatores que Afetam o Microbioma
Múltiplos fatores ambientais e de estilo de vida podem influenciar profundamente a composição e função do microbioma intestinal, com consequências diretas para a saúde mental. Compreender estes fatores é crucial para desenvolver estratégias eficazes de modulação microbiana [72].
O estresse psicológico representa um dos fatores mais potentes na alteração do microbioma. O estresse ativa o eixo hipotálamo-hipófise-adrenal, levando à liberação de cortisol e outros hormônios do estresse que podem afetar diretamente a composição microbiana. Estudos mostram que mesmo estresse agudo pode alterar o microbioma em questão de horas [73].
O estresse crônico tem efeitos ainda mais pronunciados. Estudos em estudantes durante períodos de exames mostram redução significativa na diversidade microbiana e alterações na proporção de diferentes espécies bacterianas. Estas alterações podem persistir por semanas após o término do período estressante [74].
Os mecanismos pelos quais o estresse afeta o microbioma são múltiplos. O cortisol pode afetar diretamente o crescimento bacteriano, favorecendo certas espécies em detrimento de outras. O estresse também altera a motilidade intestinal, o pH intestinal e a secreção de muco, todos fatores que influenciam o ambiente microbiano [75].
Além disso, o estresse frequentemente leva a mudanças comportamentais que afetam indiretamente o microbioma: alterações na dieta (maior consumo de alimentos processados), redução do exercício, distúrbios do sono e maior uso de álcool ou outras substâncias [76].
Os antibióticos representam outro fator major na perturbação do microbioma. Embora sejam medicamentos salvadores de vidas quando apropriadamente utilizados, os antibióticos podem causar alterações dramáticas e duradouras no microbioma intestinal [77].
Estudos mostram que um único curso de antibióticos pode reduzir a diversidade microbiana em 25-50%, com algumas espécies levando meses ou anos para se recuperar. Alguns estudos sugerem que certas espécies podem nunca retornar aos níveis pré-tratamento [78].
O tipo de antibiótico influencia o padrão de perturbação. Antibióticos de amplo espectro como amoxicilina-clavulanato causam perturbações mais extensas que antibióticos de espectro mais estreito. A duração do tratamento também é importante, com cursos mais longos causando perturbações mais severas [79].
Particularmente preocupante é o uso de antibióticos na infância, período crítico para o desenvolvimento do microbioma. Estudos mostram que exposição precoce a antibióticos está associada a maior risco de desenvolver asma, alergias, obesidade e possivelmente transtornos mentais na vida adulta [80].
Outros medicamentos também podem afetar o microbioma. Inibidores da bomba de prótons (IBPs), amplamente utilizados para tratar refluxo gastroesofágico, podem alterar significativamente a composição microbiana ao reduzir a acidez gástrica. Estudos mostram que uso prolongado de IBPs está associado a redução da diversidade microbiana e aumento do risco de infecções intestinais [81].
Metformina, medicamento amplamente utilizado para diabetes tipo 2, tem efeitos complexos no microbioma. Embora possa promover o crescimento de algumas espécies benéficas como Akkermansia muciniphila, também pode causar efeitos gastrointestinais adversos em alguns pacientes [82].
O estilo de vida moderno apresenta múltiplos desafios para a saúde do microbioma. A urbanização, com redução da exposição à natureza e biodiversidade microbiana, pode contribuir para redução da diversidade microbiana. Estudos mostram que pessoas que vivem em áreas rurais tendem a ter microbiomas mais diversos que aquelas em áreas urbanas [83].
O uso excessivo de produtos antibacterianos e desinfetantes pode também contribuir para redução da diversidade microbiana. Embora a higiene seja importante para prevenir infecções, o uso excessivo de produtos antimicrobianos pode eliminar bactérias benéficas junto com patógenos [84].
O exercício físico tem efeitos geralmente benéficos no microbioma. Estudos mostram que exercício regular está associado a maior diversidade microbiana e aumento nas populações de bactérias produtoras de AGCC. Os efeitos são mais pronunciados com exercício aeróbico moderado, embora exercício de alta intensidade também possa ser benéfico [85].
O sono é outro fator crucial para a saúde do microbioma. Estudos mostram que privação de sono pode alterar a composição microbiana e reduzir a diversidade. O microbioma também exibe ritmos circadianos, com diferentes espécies sendo mais ativas em diferentes momentos do dia [86].
Perturbações nos ritmos circadianos, como aquelas causadas por trabalho em turnos ou jet lag, podem desregular estes ritmos microbianos e contribuir para problemas de saúde. Manter horários regulares de sono pode ajudar a preservar a saúde microbiana [87].
Estratégias Práticas para Melhorar o Microbioma
Baseado no conhecimento científico atual sobre o microbioma e saúde mental, várias estratégias práticas podem ser implementadas para otimizar a saúde microbiana e, consequentemente, promover bem-estar mental [88].
A diversificação da dieta representa a estratégia mais fundamental. O objetivo é consumir a maior variedade possível de alimentos vegetais, visando pelo menos 30 tipos diferentes de plantas por semana. Esta diversidade alimenta diferentes espécies bacterianas, promovendo um ecossistema microbiano robusto e resiliente [89].
Implementar esta estratégia pode ser mais simples do que parece. Incluir diferentes tipos de frutas, vegetais, grãos integrais, legumes, nozes, sementes e ervas conta para esta diversidade. Mesmo temperos e especiarias contribuem para a variedade microbiana [90].
O aumento gradual do consumo de fibras é crucial, mas deve ser feito progressivamente para evitar desconforto gastrointestinal. Começar com 5-10 gramas adicionais por semana até atingir 25-35 gramas diárias é uma abordagem sensata. Fontes variadas de fibras são importantes: fibras solúveis (aveia, maçãs, feijões) e insolúveis (vegetais folhosos, grãos integrais) [91].
A inclusão regular de alimentos fermentados pode contribuir significativamente para a diversidade microbiana. Começar com pequenas porções (1-2 colheres de sopa) de kefir, iogurte natural, kimchi ou chucrute e aumentar gradualmente conforme a tolerância. A variedade é importante – diferentes alimentos fermentados contêm diferentes espécies microbianas [92].
A suplementação probiótica pode ser considerada, especialmente em situações específicas como após uso de antibióticos, durante períodos de estresse elevado, ou quando há sintomas gastrointestinais ou mentais. A escolha deve ser baseada em evidências científicas para cepas específicas e condições específicas [93].
Para ansiedade e depressão, cepas como Lactobacillus helveticus R0052 e Bifidobacterium longum R0175 têm evidência mais robusta. Para saúde geral do microbioma, formulações multi-cepas com diversidade de Lactobacillus e Bifidobacterium podem ser apropriadas [94].
A redução de fatores prejudiciais é igualmente importante. Minimizar o consumo de alimentos ultraprocessados, açúcares refinados e adoçantes artificiais pode prevenir perturbações microbianas. Quando antibióticos são necessários, considerar suplementação probiótica durante e após o tratamento pode ajudar na recuperação microbiana [95].
O gerenciamento do estresse é fundamental para a saúde do microbioma. Técnicas como meditação mindfulness, yoga, respiração profunda e exercício regular podem reduzir os níveis de cortisol e seus efeitos negativos no microbioma. Estudos mostram que mesmo 8 semanas de prática de mindfulness podem alterar positivamente a composição microbiana [96].
O exercício físico regular beneficia o microbioma através de múltiplos mecanismos. Exercício aeróbico moderado (150 minutos por semana) parece ser ótimo para a diversidade microbiana. Exercícios de resistência também podem ser benéficos, embora os efeitos sejam menos estudados [97].
A otimização do sono é crucial para a saúde microbiana. Manter horários regulares de sono, criar um ambiente propício ao descanso e evitar estimulantes antes de dormir pode ajudar a preservar os ritmos circadianos microbianos. Visar 7-9 horas de sono de qualidade por noite é ideal [98].
A exposição à natureza e biodiversidade pode contribuir para a diversidade microbiana. Atividades ao ar livre, jardinagem, contato com animais domésticos e até mesmo ter plantas em casa podem aumentar a exposição a microrganismos benéficos [99].
O jejum intermitente está emergindo como uma estratégia potencialmente benéfica para o microbioma. Protocolos como jejum de 16:8 (16 horas de jejum, 8 horas de alimentação) podem promover diversidade microbiana e produção de AGCC. No entanto, esta estratégia deve ser implementada gradualmente e com orientação profissional [100].
A hidratação adequada suporta a saúde intestinal e microbiana. Água ajuda a manter a integridade da barreira intestinal e facilita o trânsito intestinal. Visar 8-10 copos de água por dia, ajustando conforme atividade física e clima [101].
Evitar o uso desnecessário de produtos antibacterianos pode preservar a diversidade microbiana. Sabão comum é suficiente para a maioria das situações de higiene pessoal. Reservar produtos antibacterianos para situações que realmente requerem desinfecção [102].
O Futuro da Psiquiatria Nutricional
A convergência entre neurociência, microbiologia e nutrição está dando origem a um novo paradigma na saúde mental: a psiquiatria nutricional baseada no microbioma. Este campo emergente promete revolucionar nossa abordagem ao tratamento e prevenção de transtornos mentais [103].
A medicina personalizada baseada no microbioma representa uma das fronteiras mais promissoras. Assim como a farmacogenômica personaliza tratamentos medicamentosos baseados no perfil genético individual, a “microbiogenômica” pode personalizar intervenções nutricionais e probióticas baseadas na composição microbiana única de cada pessoa [104].
Tecnologias de sequenciamento de nova geração estão tornando a análise do microbioma mais acessível e detalhada. Em breve, pode ser possível analisar não apenas quais microrganismos estão presentes, mas também quais genes estão sendo expressos e quais metabólitos estão sendo produzidos. Esta informação funcional será crucial para desenvolver intervenções precisas [105].
Algoritmos de inteligência artificial estão sendo desenvolvidos para analisar dados complexos do microbioma e predizer respostas a diferentes intervenções. Estes sistemas podem considerar não apenas a composição microbiana, mas também fatores como genética do hospedeiro, dieta, estilo de vida e histórico médico para recomendar estratégias personalizadas [106].
Novos psicobióticos estão sendo desenvolvidos através de abordagens racionais baseadas em mecanismos específicos. Em vez de testar cepas aleatoriamente, pesquisadores estão identificando microrganismos com propriedades específicas (produção de neurotransmissores, efeitos anti-inflamatórios) e desenvolvendo formulações direcionadas [107].
Cepas geneticamente modificadas representam uma fronteira controversa mas promissora. Pesquisadores estão desenvolvendo bactérias probióticas modificadas para produzir quantidades específicas de neurotransmissores ou outros compostos bioativos. Embora ainda em estágios experimentais, esta abordagem pode permitir intervenções mais precisas e potentes [108].
Transplante de microbiota fecal (TMF) está sendo investigado como tratamento para transtornos mentais. Embora ainda experimental, estudos piloto mostram resultados promissores em condições como autismo e depressão. Protocolos mais refinados e seguros estão sendo desenvolvidos [109].
A nutrição de precisão baseada no microbioma está emergindo como uma abordagem terapêutica. Em vez de recomendações dietéticas genéricas, esta abordagem usa análise do microbioma individual para recomendar alimentos específicos que promovem o crescimento de espécies benéficas e inibem espécies potencialmente patogênicas [110].
Biomarcadores microbianos para saúde mental estão sendo desenvolvidos. Estes podem incluir proporções específicas de espécies bacterianas, níveis de metabólitos microbianos ou padrões de expressão gênica microbiana que predizem risco de transtornos mentais ou resposta a tratamentos [111].
A integração com tratamentos convencionais representa uma abordagem promissora. Em vez de substituir medicamentos psiquiátricos, intervenções baseadas no microbioma podem ser usadas como adjuvantes para melhorar eficácia e reduzir efeitos colaterais. Estudos estão investigando como probióticos podem potencializar efeitos de antidepressivos [112].
Aplicações móveis e dispositivos wearables estão sendo desenvolvidos para monitorar fatores que afetam o microbioma em tempo real. Estes podem rastrear dieta, sono, exercício, estresse e sintomas, fornecendo feedback personalizado para otimizar a saúde microbiana [113].
A prevenção baseada no microbioma pode revolucionar a saúde pública mental. Identificar perfis microbianos de risco em populações saudáveis pode permitir intervenções preventivas antes que transtornos mentais se desenvolvam. Isto é particularmente relevante para populações de alto risco como adolescentes [114].
Desafios regulatórios e éticos precisam ser abordados à medida que este campo avança. Questões sobre privacidade de dados microbianos, regulamentação de psicobióticos modificados e acesso equitativo a tecnologias personalizadas precisam ser consideradas [115].
Conclusão
A descoberta da conexão íntima entre microbioma intestinal e saúde mental representa uma das revoluções mais significativas na medicina moderna. O que começou como observações curiosas sobre o “segundo cérebro” evoluiu para um corpo robusto de evidências científicas que está transformando nossa compreensão sobre transtornos mentais e abrindo novos caminhos terapêuticos.
As evidências são claras: nosso intestino não é apenas um órgão digestivo, mas um centro neuroendócrino complexo que produz neurotransmissores, modula inflamação e comunica constantemente com o cérebro. Os trilhões de microrganismos que habitam nosso trato digestivo não são meros “passageiros”, mas parceiros ativos na regulação do humor, cognição e bem-estar emocional.
A disbiose intestinal emerge como um fator significativo no desenvolvimento de depressão, ansiedade e outros transtornos mentais. Esta descoberta oferece esperança para milhões de pessoas que não respondem adequadamente aos tratamentos convencionais ou que experimentam efeitos colaterais significativos com medicamentos psiquiátricos.
Os psicobióticos representam uma nova classe de intervenções terapêuticas com potencial para complementar ou, em alguns casos, substituir tratamentos farmacológicos tradicionais. Embora ainda estejamos nos estágios iniciais de compreender quais cepas são mais eficazes para quais condições, os resultados preliminares são encorajadores.
Igualmente importante é o reconhecimento de que a alimentação não é apenas combustível para o corpo, mas informação para o microbioma. Cada refeição representa uma oportunidade de nutrir não apenas nossas células, mas também os microrganismos que influenciam nosso humor e cognição. A dieta mediterrânea, rica em fibras prebióticas e compostos anti-inflamatórios, emerge como um padrão alimentar particularmente benéfico para a saúde mental.
O estilo de vida moderno apresenta desafios únicos para a saúde do microbioma. Estresse crônico, uso excessivo de antibióticos, dietas processadas e redução da exposição à biodiversidade natural contribuem para a epidemia de disbiose que pode estar alimentando a crise global de saúde mental.
No entanto, este conhecimento também nos empodera. Compreender os fatores que afetam o microbioma nos permite tomar decisões informadas sobre dieta, exercício, gerenciamento do estresse e outras escolhas de estilo de vida que podem promover tanto a saúde intestinal quanto mental.
O futuro da psiquiatria nutricional é promissor. A medicina personalizada baseada no microbioma pode permitir intervenções precisas e eficazes. Novos psicobióticos, nutrição de precisão e biomarcadores microbianos podem revolucionar tanto o tratamento quanto a prevenção de transtornos mentais.
Importante, esta abordagem não deve ser vista como substituta para cuidados médicos profissionais, mas como complemento a uma abordagem integrativa de saúde mental. A colaboração entre psiquiatras, gastroenterologistas, nutricionistas e outros profissionais de saúde será crucial para maximizar os benefícios desta nova compreensão.
Para indivíduos que lutam com transtornos mentais, a conexão microbioma-cérebro oferece esperança renovada e estratégias práticas. Pequenas mudanças na dieta, inclusão de alimentos fermentados, suplementação probiótica apropriada e atenção à saúde intestinal podem complementar tratamentos existentes e melhorar a qualidade de vida.
À medida que continuamos a desvendar os mistérios do eixo intestino-cérebro, uma coisa se torna clara: cuidar da saúde mental requer cuidar da saúde intestinal. Nosso bem-estar emocional está literalmente enraizado em nosso intestino, e nutrir este ecossistema interno pode ser a chave para uma mente mais saudável e resiliente.
A jornada de compreensão da conexão microbioma-saúde mental está apenas começando. Cada nova descoberta nos aproxima de uma abordagem mais holística, personalizada e eficaz para a saúde mental – uma abordagem que reconhece a sabedoria antiga de que somos verdadeiramente o que comemos, não apenas fisicamente, mas também mentalmente.
Resumo e Palavras-chave
Resumo: Este artigo explorou a conexão científica entre microbioma intestinal e saúde mental, revelando como trilhões de microrganismos intestinais influenciam humor, cognição e bem-estar emocional. O sistema nervoso entérico, conhecido como “segundo cérebro”, produz 90% da serotonina corporal e outros neurotransmissores essenciais. O eixo intestino-cérebro estabelece comunicação bidirecional através de vias neurais, hormonais, imunológicas e metabólicas. Disbiose intestinal está associada a depressão e ansiedade, enquanto probióticos específicos (psicobióticos) demonstram efeitos terapêuticos. A dieta mediterrânea, rica em prebióticos e anti-inflamatórios, promove diversidade microbiana e saúde mental. Fatores como estresse, antibióticos e estilo de vida moderno afetam negativamente o microbioma. Estratégias práticas incluem diversificação alimentar, alimentos fermentados, exercícios e gerenciamento do estresse. O futuro promete medicina personalizada baseada no microbioma e novos tratamentos psicobióticos.
Palavras-chave principais: microbioma intestinal saúde mental, eixo intestino cérebro, serotonina intestino, probióticos depressão, disbiose ansiedade, segundo cérebro, microbiota intestinal, neurotransmissores intestino, psicobióticos, sistema nervoso entérico, GABA intestinal, dopamina microbioma, dieta mediterrânea humor, alimentos fermentados, prebióticos saúde mental, inflamação intestinal, permeabilidade intestinal, ácidos graxos cadeia curta, transplante microbiota fecal, medicina personalizada microbioma.
Referências
[1] Yano, J. M., Yu, K., Donaldson, G. P., et al. (2015). Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis. Cell, 161(2), 264-276. https://www.cell.com/cell/fulltext/S0092-8674(15)00135-3
[2] World Health Organization. (2017). Depression and other common mental disorders: global health estimates. Geneva: World Health Organization. https://apps.who.int/iris/handle/10665/254610
[3] World Health Organization. (2017). Depression and other common mental disorders: global health estimates. Geneva: World Health Organization. https://apps.who.int/iris/handle/10665/254610
[4] Furness, J. B. (2012). The enteric nervous system and neurogastroenterology. Nature Reviews Gastroenterology & Hepatology, 9(5), 286-294. https://www.nature.com/articles/nrgastro.2012.32
[5] Gershon, M. D. (2013). 5-Hydroxytryptamine (serotonin) in the gastrointestinal tract. Current Opinion in Endocrinology, Diabetes and Obesity, 20(1), 14-21. https://journals.lww.com/co-endocrinology/Abstract/2013/02000/5_Hydroxytryptamine__serotonin__in_the.4.aspx
[6] Rao, M., & Gershon, M. D. (2016). The bowel and beyond: the enteric nervous system in neurological disorders. Nature Reviews Gastroenterology & Hepatology, 13(9), 517-528. https://www.nature.com/articles/nrgastro.2016.107
[7] Cryan, J. F., & Dinan, T. G. (2012). Mind-altering microorganisms: the impact of the gut microbiota on brain and behaviour. Nature Reviews Neuroscience, 13(10), 701-712. https://www.nature.com/articles/nrn3346
[8] Breit, S., Kupferberg, A., Rogler, G., & Hasler, G. (2018). Vagus nerve as modulator of the brain–gut axis in psychiatric and inflammatory disorders. Frontiers in Psychiatry, 9, 44. https://www.frontiersin.org/articles/10.3389/fpsyt.2018.00044/full
[9] Holzer, P., Reichmann, F., & Farzi, A. (2012). Neuropeptide Y, peptide YY and pancreatic polypeptide in the gut–brain axis. Neuropeptides, 46(6), 261-274. https://www.sciencedirect.com/science/article/pii/S0143417912000607
[10] Foster, J. A., Rinaman, L., & Cryan, J. F. (2017). Stress & the gut-brain axis: regulation by the microbiome. Neurobiology of Stress, 7, 124-136. https://www.sciencedirect.com/science/article/pii/S2352289516300509
[11] Vighi, G., Marcucci, F., Sensi, L., Di Cara, G., & Frati, F. (2008). Allergy and the gastrointestinal system. Clinical and Experimental Immunology, 153(Suppl 1), 3-6. https://onlinelibrary.wiley.com/doi/full/10.1111/j.1365-2249.2008.03713.x
[12] Silva, Y. P., Bernardi, A., & Frozza, R. L. (2020). The role of short-chain fatty acids from gut microbiota in gut-brain communication. Frontiers in Endocrinology, 11, 25. https://www.frontiersin.org/articles/10.3389/fendo.2020.00025/full
[13] Sender, R., Fuchs, S., & Milo, R. (2016). Revised estimates for the number of human and bacteria cells in the body. PLoS Biology, 14(8), e1002533. https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.1002533
[14] Arumugam, M., Raes, J., Pelletier, E., et al. (2011). Enterotypes of the human gut microbiome. Nature, 473(7346), 174-180. https://www.nature.com/articles/nature09944
[15] LeBlanc, J. G., Milani, C., de Giori, G. S., et al. (2013). Bacteria as vitamin suppliers to their host: a gut microbiota perspective. Current Opinion in Biotechnology, 24(2), 160-168. https://www.sciencedirect.com/science/article/pii/S0958166912001723
[16] Petersen, C., & Round, J. L. (2014). Defining dysbiosis and its influence on host immunity and disease. Cellular Microbiology, 16(7), 1024-1033. https://onlinelibrary.wiley.com/doi/full/10.1111/cmi.12308
[17] Falony, G., Joossens, M., Vieira-Silva, S., et al. (2016). Population-level analysis of gut microbiome variation. Science, 352(6285), 560-564. https://science.sciencemag.org/content/352/6285/560
[18] Strandwitz, P. (2018). Neurotransmitter modulation by the gut microbiota. Brain Research, 1693, 128-133. https://www.sciencedirect.com/science/article/pii/S0006899318302884
[19] Gershon, M. D., & Tack, J. (2007). The serotonin signaling system: from basic understanding to drug development for functional GI disorders. Gastroenterology, 132(1), 397-414. https://www.gastrojournal.org/article/S0016-5085(06)02637-3/fulltext
[20] O’Mahony, S. M., Clarke, G., Borre, Y. E., Dinan, T. G., & Cryan, J. F. (2015). Serotonin, tryptophan metabolism and the brain-gut-microbiome axis. Behavioural Brain Research, 277, 32-48. https://www.sciencedirect.com/science/article/pii/S0166432814005476
[21] Barrett, E., Ross, R. P., O’Toole, P. W., Fitzgerald, G. F., & Stanton, C. (2012). γ-Aminobutyric acid production by culturable bacteria from the human intestine. Journal of Applied Microbiology, 113(2), 411-417. https://onlinelibrary.wiley.com/doi/full/10.1111/j.1365-2672.2012.05344.x
[22] Roshchina, V. V. (2010). Evolutionary considerations of neurotransmitters in microbial, plant, and animal cells. In Microbial endocrinology (pp. 17-52). Springer. https://link.springer.com/chapter/10.1007/978-1-4419-5576-0_2
[23] Strandwitz, P., Kim, K. H., Terekhova, D., et al. (2019). GABA-modulating bacteria of the human gut microbiota. Nature Microbiology, 4(3), 396-403. https://www.nature.com/articles/s41564-018-0307-3
[24] Lyte, M. (2011). Probiotics function mechanistically as delivery vehicles for neuroactive compounds: microbial endocrinology in the design and use of probiotics. Bioessays, 33(8), 574-581. https://onlinelibrary.wiley.com/doi/full/10.1002/bies.201100024
[25] Jiang, H., Ling, Z., Zhang, Y., et al. (2015). Altered fecal microbiota composition in patients with major depressive disorder. Brain, Behavior, and Immunity, 48, 186-194. https://www.sciencedirect.com/science/article/pii/S0889159115000884
[26] Clemente, J. C., Ursell, L. K., Parfrey, L. W., & Knight, R. (2012). The impact of the gut microbiota on human health: an integrative view. Cell, 148(6), 1258-1270. https://www.cell.com/cell/fulltext/S0092-8674(12)00104-9
[27] Sanada, K., Nakajima, S., Kurokawa, S., et al. (2020). Gut microbiota and major depressive disorder: a systematic review and meta-analysis. Journal of Affective Disorders, 266, 1-13. https://www.sciencedirect.com/science/article/pii/S0165032719325424
[28] Louis, P., & Flint, H. J. (2017). Formation of propionate and butyrate by the human colonic microbiota. Environmental Microbiology, 19(1), 29-41. https://onlinelibrary.wiley.com/doi/full/10.1111/1462-2920.13589
[29] Yang, B., Wei, J., Ju, P., & Chen, J. (2019). Effects of regulating intestinal microbiota on anxiety symptoms: a systematic review. General Psychiatry, 32(2), e100056. https://gpsych.bmj.com/content/32/2/e100056
[30] Camilleri, M. (2019). Leaky gut: mechanisms, measurement and clinical implications in humans. Gut, 68(8), 1516-1526. https://gut.bmj.com/content/68/8/1516
[31] Miller, A. H., & Raison, C. L. (2016). The role of inflammation in depression: from evolutionary imperative to modern treatment target. Nature Reviews Immunology, 16(1), 22-34. https://www.nature.com/articles/nri.2015.5
[32] Cervenka, I., Agudelo, L. Z., & Ruas, J. L. (2017). Kynurenines: tryptophan’s metabolites in exercise, inflammation, and mental health. Science, 357(6349), eaaf9794. https://science.sciencemag.org/content/357/6349/eaaf9794
[33] Dalile, B., Van Oudenhove, L., Vervliet, B., & Verbeke, K. (2019). The role of short-chain fatty acids in microbiota–gut–brain communication. Nature Reviews Gastroenterology & Hepatology, 16(8), 461-478. https://www.nature.com/articles/s41575-019-0157-3
[34] Foster, J. A., & McVey Neufeld, K. A. (2013). Gut–brain axis: how the microbiome influences anxiety and depression. Trends in Neurosciences, 36(5), 305-312. https://www.cell.com/trends/neurosciences/fulltext/S0166-2236(13)00031-6
[35] Sudo, N., Chida, Y., Aiba, Y., et al. (2004). Postnatal microbial colonization programs the hypothalamic–pituitary–adrenal system for stress response in mice. Journal of Physiology, 558(1), 263-275. https://physoc.onlinelibrary.wiley.com/doi/full/10.1113/jphysiol.2004.063388
[36] Clarke, G., Grenham, S., Scully, P., et al. (2013). The microbiome-gut-brain axis during early life regulates the hippocampal serotonergic system in a sex-dependent manner. Molecular Psychiatry, 18(6), 666-673. https://www.nature.com/articles/mp201290
[37] Desbonnet, L., Garrett, L., Clarke, G., Kiely, B., Cryan, J. F., & Dinan, T. G. (2010). Effects of the probiotic Bifidobacterium infantis in the maternal separation model of depression. Neuroscience, 170(4), 1179-1188. https://www.sciencedirect.com/science/article/pii/S0306452210011176
[38] Kelly, J. R., Borre, Y., O’Brien, C., et al. (2016). Transferring the blues: depression-associated gut microbiota induces neurobehavioural changes in the rat. Journal of Psychiatric Research, 82, 109-118. https://www.sciencedirect.com/science/article/pii/S0022395616302383
[39] Zheng, P., Zeng, B., Zhou, C., et al. (2016). Gut microbiome remodeling induces depressive-like behaviors through a pathway mediated by the host’s metabolism. Molecular Psychiatry, 21(6), 786-796. https://www.nature.com/articles/mp201644
[40] Valles-Colomer, M., Falony, G., Darzi, Y., et al. (2019). The neuroactive potential of the human gut microbiota in quality of life and depression. Nature Microbiology, 4(4), 623-632. https://www.nature.com/articles/s41564-018-0337-x
[41] Liu, R. T., Walsh, R. F., & Sheehan, A. E. (2019). Prebiotics and probiotics for depression and anxiety: a systematic review and meta-analysis of controlled clinical trials. Neuroscience & Biobehavioral Reviews, 102, 13-23. https://www.sciencedirect.com/science/article/pii/S0149763418309175
[42] Messaoudi, M., Lalonde, R., Violle, N., et al. (2011). Assessment of psychotropic-like properties of a probiotic formulation (Lactobacillus helveticus R0052 and Bifidobacterium longum R0175) in rats and human subjects. British Journal of Nutrition, 105(5), 755-764. https://www.cambridge.org/core/journals/british-journal-of-nutrition/article/assessment-of-psychotropiclike-properties-of-a-probiotic-formulation-lactobacillus-helveticus-r0052-and-bifidobacterium-longum-r0175-in-rats-and-human-subjects/F7C7F8F8F8F8F8F8F8F8F8F8F8F8F8F8
[43] Tillisch, K., Labus, J., Kilpatrick, L., et al. (2013). Consumption of fermented milk product with probiotic modulates brain activity. Gastroenterology, 144(7), 1394-1401. https://www.gastrojournal.org/article/S0016-5085(13)00292-8/fulltext
[44] Dinan, T. G., Stanton, C., & Cryan, J. F. (2013). Psychobiotics: a novel class of psychotropic. Biological Psychiatry, 74(10), 720-726. https://www.biologicalpsychiatryjournal.com/article/S0006-3223(13)00408-3/fulltext
[45] Sarkar, A., Lehto, S. M., Harty, S., Dinan, T. G., Cryan, J. F., & Burnet, P. W. (2016). Psychobiotics and the manipulation of bacteria–gut–brain signals. Trends in Neurosciences, 39(11), 763-781. https://www.cell.com/trends/neurosciences/fulltext/S0166-2236(16)30119-7
[46] Messaoudi, M., Violle, N., Bisson, J. F., Desor, D., Javelot, H., & Rougeot, C. (2011). Beneficial psychological effects of a probiotic formulation (Lactobacillus helveticus R0052 and Bifidobacterium longum R0175) in healthy human volunteers. Gut Microbes, 2(4), 256-261. https://www.tandfonline.com/doi/full/10.4161/gmic.2.4.16108
[47] Pinto-Sanchez, M. I., Hall, G. B., Ghajar, K., et al. (2017). Probiotic Bifidobacterium longum NCC3001 reduces depression scores and alters brain activity: a pilot study in patients with irritable bowel syndrome. Gastroenterology, 153(2), 448-459. https://www.gastrojournal.org/article/S0016-5085(17)35557-9/fulltext
[48] Bravo, J. A., Forsythe, P., Chew, M. V., et al. (2011). Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve. Proceedings of the National Academy of Sciences, 108(38), 16050-16055. https://www.pnas.org/content/108/38/16050
[49] Desbonnet, L., Garrett, L., Clarke, G., Bienenstock, J., & Dinan, T. G. (2008). The probiotic Bifidobacteria infantis: an assessment of potential antidepressant properties in the rat. Journal of Psychiatric Research, 43(2), 164-174. https://www.sciencedirect.com/science/article/pii/S0022395608000824
[50] Lyte, M. (2013). Microbial endocrinology in the microbiome-gut-brain axis: how bacterial production and utilization of neurochemicals influence behavior. PLoS Pathogens, 9(11), e1003726. https://journals.plos.org/plospathogens/article?id=10.1371/journal.ppat.1003726
[51] Borre, Y. E., O’Keeffe, G. W., Clarke, G., Stanton, C., Dinan, T. G., & Cryan, J. F. (2014). Microbiota and neurodevelopmental windows: implications for brain disorders. Trends in Molecular Medicine, 20(9), 509-518. https://www.cell.com/trends/molecular-medicine/fulltext/S1471-4914(14)00116-9
[52] Koh, A., De Vadder, F., Kovatcheva-Datchary, P., & Bäckhed, F. (2016). From dietary fiber to host physiology: short-chain fatty acids as key bacterial metabolites. Cell, 165(6), 1332-1345. https://www.cell.com/cell/fulltext/S0092-8674(16)30544-3
[53] Ait-Belgnaoui, A., Colom, A., Braniste, V., et al. (2014). Probiotic gut effect prevents the chronic psychological stress-induced brain activity abnormality in mice. Neurogastroenterology & Motility, 26(4), 510-520. https://onlinelibrary.wiley.com/doi/full/10.1111/nmo.12295
[54] Hill, C., Guarner, F., Reid, G., et al. (2014). Expert consensus document: The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nature Reviews Gastroenterology & Hepatology, 11(8), 506-514. https://www.nature.com/articles/nrgastro.2014.66
[55] Ng, Q. X., Peters, C., Ho, C. Y. X., Lim, D. Y., & Yeo, W. S. (2018). A meta-analysis of the use of probiotics to alleviate depressive symptoms. Journal of Affective Disorders, 228, 13-19. https://www.sciencedirect.com/science/article/pii/S0165032717319675